
Некоторые аспекты количественной оценки влияния света на циркадианные физиологические функции
Немаловажным аспектом хронофизиологических исследований является валидность методов оценки, воспроизводимость результатов, разделение отдельной функции и системного состояния организма. В хронофизиологии используется несколько показателей (маркеров) для измерения величины циркадных реакций:
- суточное соотношение времени активности и покоя [1, 2];
- время начала и продолжительность сна (в том числе различных фаз, стадий и других событий сна) [40];
- базальная (глубокая) температура тела (наиболее часто рассчитывается период, амплитуда, минимум, фазовые углы ритма) [14, 56];
- концентрация гормона мелатонина (минимальная, максимальная, время начала роста концентрации и др.) [44, 54];
- концентрация кортизола и других гормонов [37].
Следует обратить особое внимание на то, что в хронофизиологии окончательно не решен вопрос о наиболее «адекватном» показателе, отражающем регуляцию суточных функций в полной мере. С точки зрения оценки универсальности и системности функций наиболее полно циркадианную регуляцию отражает состояние цикла «сон-бодрствование» и цикла «покой-активность». Эти циклы являются проявлением системной деятельности организма и имплицитно включают более частные. Между тем в отечественной периодической литературе по светотехнике, в значительной степени под влиянием зарубежных работ, наметилось преобладание одностороннего взгляда на оценку воздействия света на циркадную регуляцию, путем расчета показателей суточной концентрации мелатонина [3, 6]. Наша статья посвящена рассмотрению вопроса о пригодности мелатонина в качестве однозначного циркадианного маркера для светотехники.
Мелатонин (МЛТ) — пептид, вырабатываемый шишковидной железой (эпифизом), открыт в 1958 году А. Б. Лернером. Считается, что концентрация мелатонина в крови и моче подвержена суточным колебаниям — остается на минимальном уровне в течение активной фазы деятельности (днем) и значительно увеличивается во сне (ночью). Высказывалось предположение, что мелатонин является своеобразным сигналом смены времени суток (у ночных и дневных животных). На этом явлении, собственно, и основывается взгляд на мелатонин как на показатель циркадианной системы регуляции животных и человека. Кроме того, получены многочисленные свидетельства, что выработка и секреция мелатонина тормозится светом (точнее, сигналами с рецепторов сетчатки глаза на свет) [9]. Последнее обстоятельство, по мнению многих авторов, делает МЛТ особенно привлекательным в качестве показателя для оценки влияния искусственного освещения на ритмы физиологических процессов [21, 45]. Однако некоторые факты затрудняют столь прямолинейную трактовку биологической роли МЛТ. В отличие от животных у человека социальная активность играет ведущую роль в организации суточного режима, в значительной степени модифицируя экологические влияния, к которым относится чередование темного и светлого времени суток и сезонные изменения фотопериода [50].
На сегодня достоверно установлено участие мелатонина только в регуляции репродуктивной активности животных [27, 37]. Многие исследования указывают на то, что и у человека мелатонин влияет на общее состояние репродуктивной сферы, а именно блокирует ее активность до пубертатного возраста (11–14 лет) через регуляцию половых гормонов [59]. Это подтверждает относительно резкое и значительное изменение концентрации ночного МЛТ на рубеже совершеннолетия [25, 32] (рис. 1). Так, Ф. Валдхаусер приводит следующие цифры ночного уровня мелатонина (в пг/мл): до 6 мес. — 27,3 ±5,4; 1–3 года — 329,5 ±42,0; 15–20 лет — 62,5±9,0; 70–90 лет — 29,2 ±6,1 [68]. Зависимость уровня МЛТ от возраста серьезно ограничивает его роль в качестве универсального показателя состояния циркадной системы. К тому же в обозримом будущем сложно представить использование искусственного освещения с учетом возрастных особенностей пользователей.

Рис. 1. Концентрация МЛТ в сыворотке в ночное время у 367 субъектов (210 мужчин и 157 женщин) в возрасте от 3 дней до 90 лет.
Для преобразования концентраций MLT в единицы СИ (наномоль на L) умножьте на 0,0043478 [68]
Затруднения вызывает и значительная индивидуальная разница показателей концентрации мелатонина. Большинство исследователей указывают значения МЛТ днем: 7–15 пг/мл, ночью: 48–83 пг/мл [41, 47, 54], однако разброс значений лежит в пределах 20–150 пг/мл и даже больше. Например, в работе [61] дневная концентрация МЛТ у обследованных лиц достигает 54 пг/мл. Финские исследователи указывают уровень ночного МЛТ как 180–370 фмоль/мл, что превышает фоновое значение в 5–12 раз [66]. В то же время их коллеги в течение года определяли дневной (с 10:00 до 12:00) уровень МЛТ и получили результаты: (22,4±3,9) пмоль/л в августе и (37,1±6,9) пмоль/л в декабре [47], что свидетельствует о сезонных колебаниях его уровня. У лиц с повышенной чувствительностью к нестабильности фотопериода колебания концентрации МЛТ подвержены еще большему разбросу. Так, по данным Э. Салинас и соавторов, ночные концентрации мелатонина колебались в пределах 20–160 пг/мл [58].
Максимальные значения концентрации МЛТ в крови, слюне и моче в ночное время подвержены значительным вариациям у разных индивидов и у одного и того же индивида не только в разные сезоны года, но даже и в разные дни, к тому же акрофаза ритма мелатонина (момент максимальной концентрации) также варьируется в течение темного времени суток. Не выявлено значимых корреляций между концентрацией МЛТ и стадиями, фазами и циклами сна [67].
Для того чтобы считать МЛТ маркером циркадианного ритма, необходимо точно соотнести одну из характеристик суточного ритма концентрации МЛТ (максимум концентрации, надир и др.) с моментом времени суток. Время максимальной концентрации МЛТ определяется весьма относительно — между полуночью и 05:00 ч [10, 44, 54]. Большинство исследователей полагают, что для оценки состояния циркадианной системы целесообразно использовать момент начала увеличения концентрации этого вещества в плазме крови, связанный с изменением освещения и косвенно — с началом сна. Считается, что концентрация МЛТ в плазме крови человека обычно начинает повышаться между 18:00 и 20:00 ч [54]. Однако в этом вопросе нет единства мнений [41]. Чтобы различать момент подъема концентрации МЛТ в крови (и соответственно суточную фазу), был введен показатель DLMO (Dim Light Melatonin Onset) — время начала секреции мелатонина при тусклом свете — момент времени, когда концентрация МЛТ превышает уровень 10 пг/мл в плазме, обычно регистрируемый за 2–3 ч перед сном [44]. При этом понятие «тусклый свет» определено весьма приблизительно и только в отношении интенсивности светового потока.
Существенные трудности представляют значительные индивидуальные различия во времени начала роста концентрации МЛТ. Так, Триндер и соавторы из 12 обследованных человек смогли выбрать только шестерых, у которых повышение уровня МЛТ до 24:00 легко идентифицировалось [63]. В то же время группа ученых из Техаса выяснила, что у некоторых субъектов повышение концентрации мелатонина в плазме начинается уже в полдень, к 16:00 достигая значений, сопоставимых с ночным уровнем [67].
В исследованиях зарубежных авторов значения концентрации МЛТ для DLMO зачастую выбираются произвольно. Например, в работе [10] значение МЛТ в слюне для DLMO принято в 3 пг/мл, а в одной и той же работе канадских авторов концентрация МЛТ для DLMO принимается то в 1,0 пг/мл, то в 2,7 пг/мл [55]. Существенно, что во многих зарубежных исследованиях значение DLMO фигурирует в качестве маркера фазы циркадианной системы [45. 57], в то время как фактически DLMO является маркером суточной фазы концентрации мелатонина [10].
Важным моментом оценки роли мелатонина как маркера системы биологических ритмов являются также сезонные колебания его уровня [34, 61]. Еще в 1985 году чешские исследователи обнаружили сезонные колебания ночного уровня МЛТ. Примерно у половины обследованных лиц зимой он в два раза превосходил летний [34]. Отличается и сезонная продолжительность суточной секреции МЛТ. Например, в исследовании японских ученых показано, что ночной уровень МЛТ осенью значительно превосходит таковой в другие сезоны года. Правда, у 25% испытуемых изменения были минимальными [64]. В работе Х. Мартикайнен и коллег указывается, что при ежемесячном сборе данных дневные уровни мелатонина в сыворотке крови показали резкое увеличение в мае-июле и столь же резкое снижение в августе [47]. Сезонные колебания концентрации МЛТ отмечаются и при оценке влияния на нее искусственного освещения. Например, в работе [51] отмечается снижение МЛТ на фоне искусственного освещения — летом на 12%, а зимой на 18%. По данным этого автора, осенью и весной концентрация МЛТ составила в 24:00 (до засветки) — 35, летом — 48, а зимой — 40 пг/мл, таким образом, сезонная разница подавления МЛТ составила 27–37% от его уровня.
Концентрации мелатонина в биологических жидкостях весьма чувствительны к изменениям геомагнитного поля и атмосферного электричества [15, 29], что весьма затрудняет сравнение показателей не только в разных подгруппах, но и у одного и того же субъекта.
Подавление МЛТ светом было обнаружено в эпифизе и сыворотке крови крыс [33]. То же и у человека [48]. Однако зачастую эти данные нуждаются в уточнении. Например, по данным Ван де Веркена, коротковолновый полихроматический белый свет интенсивностью 254 лк лишь незначительно (на 6%) подавляет МЛТ в слюне [69]. В работе французских исследователей концентрация мелатонина держалась на уровне 3000–6000 нг/2 ч в течение 7 ч на фоне освещения интенсивностью 100 лк (рис. 2). Более того, многие исследователи получили прямо противоположный результат — концентрация ночного МЛТ не снижается даже при высокой интенсивности освещения. В исследовании Т. Акерштеда, несмотря на освещение, определялся «ярко выраженный ночной пик циркадного ритма мелатонина в моче как во время нормального чередования сна/бодрствования, так и во время лишения сна в течение 64 ч» [8]. Сохранение циркадного ритма мелатонина в условиях освещения хорошо согласуется с результатами, полученными Линчом и др. (1975) и Джимерсон и др. (1977). Однако это расходится с гипотезой подавления МЛТ светом. Авторы, обсуждая полученные результаты, высказывают свои сомнения: «Поскольку все известные внешние синхронизаторы хорошо контролировались, представляется вероятным, что причиной сохранения мелатонина может быть либо то обстоятельство, что человеческий эпифиз менее чувствителен к свету (чем у животных), или что выделение с мочой не отражает эпифизарный синтез мелатонина» [8].

Рис. 2. Средние (+ SE) профили концентрации aMT6s (в нг/2 ч) во время лишения сна. Сравнивались значения при освещении 100 лк (темные кружки) и 1000 лк (темные квадраты) [23]
Схожие результаты получены и другими исследователями [36, 42]. Джимерсон и соавторы (1977) обнаружили «повышение ночной экскреции мелатонина у здоровых добровольцев и пациентов с депрессией в течение одной ночи депривации сна при постоянном свете» [36]. В работе японских ученых выявлено, что свет 5000 лк больше смещает фазу МЛТ (1:58 ч), чем фазу температуры тела (1:12 ч) [42].
В исследовании французских авторов тусклый дневной свет интенсивностью 300 лк в течение недели вызывал значительное повышение ночного МЛТ в отличие от освещения интенсивностью 3000 лк, при котором ночные уровни этого пептида значимо не отличались от контроля [58].
Затрудняют однозначную интерпретацию данных о роли МЛТ в регуляции биологических ритмов и гендерные (половые) различия в синтезе и реакции подавления МЛТ светом, отмеченные в [43, 52]. По данным финских исследователей, в фолликулярной фазе у женщин отмечаются высокие уровни мелатонина, особенно зимой [39]. Гендерные различия в синтезе МЛТ и его подавлении светом отмечают также П. Бойс и Д. Кэнвэй [12].
Весьма вероятно, что у млекопитающих мелатонин играет менее важную роль, чем у пресмыкающихся, причем у видов, ведущих дневной и ночной образ жизни, физиологическое значение этого гормона также имеет некоторые отличия [26]. Еще меньшую роль в регуляции биологической ритмики играет мелатонин у человека, возможно являясь в этом отношении рудиментом.
Реального фазового сдвига циркадного ритма мочевого МЛТ не отмечается после воздействия ночного света интенсивностью 1000 лк [23] (рис. 2). Интересные данные приведены в [26]. Диапазон значений фазовых углов (время между выключением света и началом секреции МЛТ, а также время между включением света и прекращением секреции МЛТ) уже на третий «день» искусственных 28-часовых суток достигает 5 ч. Но еще примечательнее, что сразу по окончании двухнедельного эксперимента принудительной десинхронизации время начала и окончания секреции МЛТ практически не зависело от освещения! Причем начало секреции МЛТ в одинаковых условиях 28-часовых искусственных суток смещается у разных испытуемых разнонаправлено: у одних с опережением фазы, у других с задержкой [26] (см. также рис. 3).
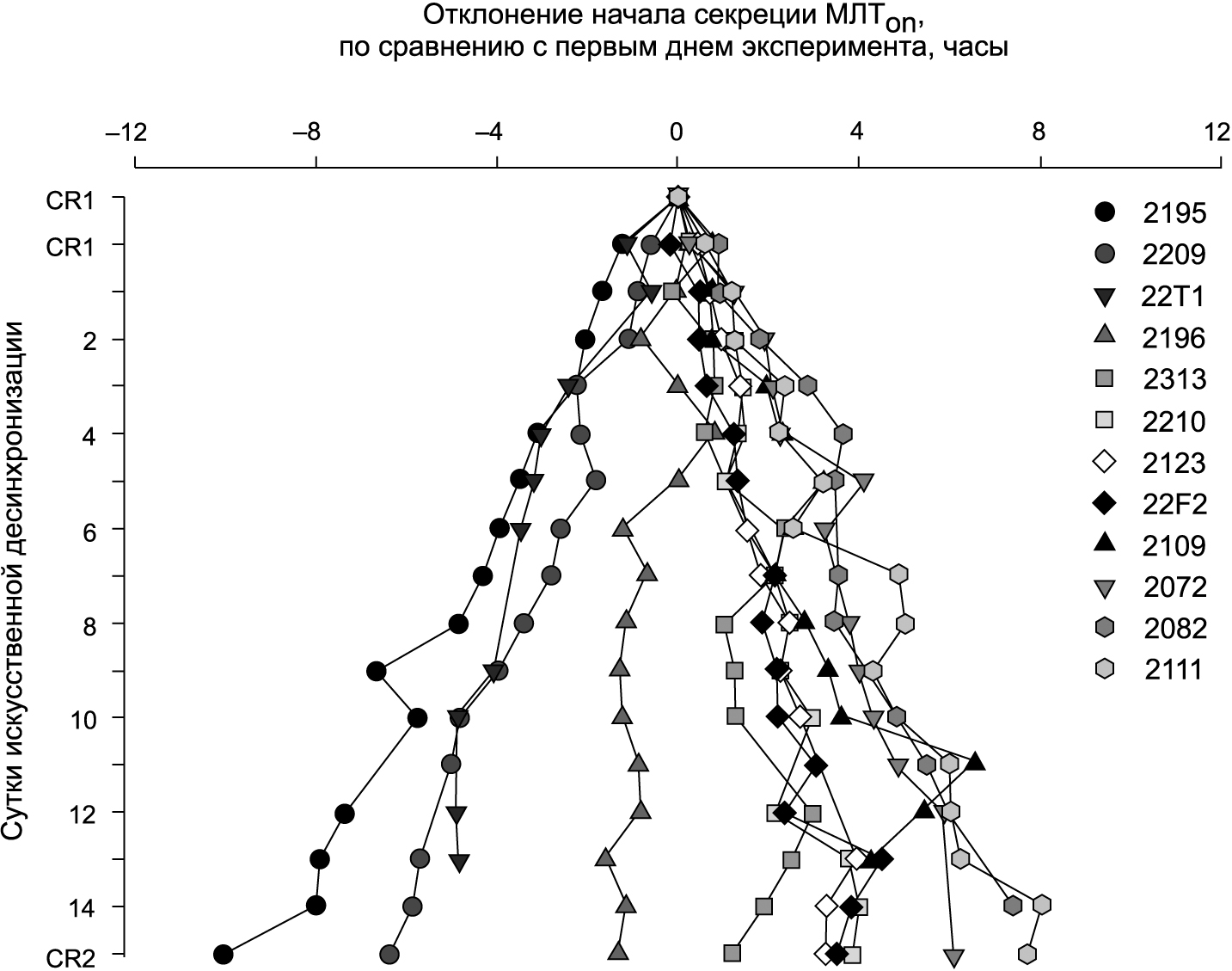
Рис. 3. Ежедневные оценки фазы начала секреции мелатонина (МЛТon) на протяжении эксперимента искусственной десинхронизации [26]
Особый интерес представляет исследование П. Натан и соавторов, в котором сравнивались уровни МЛТ у пяти женщин и мужчин в условиях освещения 200, 500, 1000 и 3000 лк с 21:00 до 02:30 [52]. Даже на фоне света 3000 лк концентрация МЛТ увеличилась с 3,9–5,0 пг/мл до 46,0–53,8 пг/мл [52]. В другой работе этого автора часовая засветка тусклым светом 200 лк вызвала снижение МЛТ с 35–48 до 28–40 пг/мл, но никак не подавляла его совсем [51].
Разница в данных удручающая. Так, П. Бойс и Д. Кэнвэй, изучая воздействие света интенсивностью 1000–2500 лк на концентрацию МЛТ, отметили, что после первоначального снижения концентрации на 15–30% его скорость значительно замедлялась, а в некоторых случаях концентрация начинала расти. Так, на фоне освещения 2500 лк средний уровень пептида увеличился с 40,93 до 44,18 пг/мл; после 2 ч освещения 2000 лк и снижения концентрации МЛТ с 67,44 до 42,56 уровень МЛТ вновь повысился до 44,42 пг/мл [12]. В то же время Триндер и др. отметили, что эффективно подавляет ночной рост МЛТ свет интенсивностью 500–2500 лк и даже 250 лк, однако эти же авторы отметили, что на фоне освещения 250 лк концентрация МЛТ начала увеличиваться через 2 ч [63].
Установлено также, что снижение концентрации мелатонина на свет одной и той же интенсивности зависит от предыдущего уровня освещенности — «световой истории» [17]. Более высокая, чем ожидалось, чувствительность к свету низкой интенсивности может быть связана с описанными эффектами предшествующей световой «истории», которые показывают, что реакция МЛТ на свет может повышаться после фоновой (длительной) освещенности низкой интенсивности [28, 60]. Сравнение ответов подавления МЛТ монохроматическим светом (460 нм) выявило значительное уменьшение подавления МЛТ после адаптации к тусклому белому по сравнению с темновой адаптацией [35]. Сложный процесс влияния света на уровень МЛТ определяется интегральными, если не сезонными, то суточными показателями уровня освещенности, и уже поэтому представляется весьма сомнительным для однозначного суждения о влиянии освещения на систему биологических ритмов.
Существенные ограничения в использовании МЛТ в качестве маркера циркадианной фазы признают даже исследователи, активно использующие этот подход [55].
Есть сообщения о том, что вариации уровня МЛТ при воздействии одного и того же светового потока зависят даже от цвета глаз испытуемых [30]. Процент подавления секреции мелатонина через 2 ч после начала световой экспозиции был значительно больше у светлоглазых европеоидов ((88,9 ±4,2)%), чем у темноглазых азиатов ((73,4 ±20,0)%, р< 0,01) [30].
Помимо эпифиза, МЛТ вырабатывается энтерохромаффинными клетками слизистой оболочки желудочно-кишечного тракта (ЖКТ), в которых обнаружены ферменты для синтеза серотонина и специфические ферменты для синтеза МЛТ (серотонин-N-ацетилтрансфераза и гидроксииндол-О-метилтрансфераза). Общее содержание мелатонина в ЖКТ в 400 раз больше, чем в эпифизе, и в 10–100 раз больше, чем в плазме крови [13]. При этом отсутствуют методы различения центрального (эпифизарного) и периферического МЛТ в биологических жидкостях. Кроме того, существует проблема чувствительности методов определения мелатонина, существенно затрудняющая сопоставление данных, полученных различными исследователями.
В последние два десятилетия предлагается использовать концентрацию МЛТ в качестве маркера циркадианного ритма [9, 21]. В этом значении ритм МЛТ даже противопоставляется ритму температуры. Высказывается убеждение, что в отличие от ритма МЛТ «ритм температуры обладает лишь слабым эндогенным компонентом» [49]. Однако столь радикальное мнение уважаемых исследователей основано на некорректном сравнении акрофаз ритма МЛТ и базальной температуры. Корректно сравнивать акрофазу ритма МЛТ и положение надира базальной температуры, что в корне меняет выводы. К тому же ритм базальной температуры тела (мозга) очень четко коррелирует как с фазами, так и со стадиями ночного сна, что указывает на его значительную циркадианную составляющую.
Вышеперечисленные факты свидетельствуют о трудностях однозначной оценки участия МЛТ в регуляции биологических ритмов освещением. Его роль в этом процессе еще предстоит уточнить. В то же время получены убедительные доказательства стабильности и большей валидности ритма базальной температуры тела в качестве маркера циркадианной регуляции, в том числе в исследованиях биологических эффектов искусственного освещения.
Метод оценки состояния суточных ритмов по показателям базальной температуры тела предложен более 100 лет назад, хорошо освоен при исследовании состояния здоровья экипажей подводных лодок еще в середине ХХ века [40]. Стоит отметить, что наиболее серьезные исследования влияния искусственного освещения на биологические ритмы человека, в частности в военной авиации и на флоте, выполнены с опорой именно на суточный ритм температуры [18, 24, 31, 38, 40]. Значения фазового угла между Тmin и сном (ΨCBTmin) используются в качестве оценки базового фазового угла захвата в сложных экспериментах искусственной десинхронизации и оценки влияния света на циркадианные функции человека [26] (рис. 4).

Рис. 4. Средние колебания циркадных переменных и уменьшение амплитуды. Средние значения субъективной бодрости, кортизола в плазме, базальной температуры тела и плазменного мелатонина в состоянии спокойствия у участников с уменьшением амплитуды мелатонина >50% (темные символы, n = 7) по сравнению с теми, у кого снижение было <50% (светлые символы, n = 7). Все данные согласуются со временем установленного минимума ритма температуры тела. Полосы ошибок показывают 1 SEM [71]
Физиологические механизмы терморегуляции хорошо изучены [11, 22, 56], в том числе и в связи со сном [46]. Температура тела считается универсальным показателем состояния системы циркадной регуляции у млекопитающих [14].
Значительный объем исследований подтверждают гипотезу о том, что МЛТ может быть посредником изменений в предрасположенности ко сну через эффекты терморегуляции [20, 65]. Однако известно, что температура мозга, как правило, уменьшается после начала сна [16]. Это указывает на то, что эндогенный мелатонин может не участвовать непосредственно в изменениях температуры, связанных с началом сна.
В докторской диссертации [57] установлено, что значительные ежедневные фазовые модуляции и изменения концентрации МЛТ наблюдаются при «всех режимах тусклого света», что позволяет предположить большую «реактивность» ритма МЛТ по сравнению с температурным по отношению к внешним захватывающим влияниям.
Стоит указать на то обстоятельство, что для сохранения «жизнеспособности» организма важно не столько точное воспроизведение 24-часового периода, сколько поддержание согласованности различных физиологических процессов. С точки же зрения адаптационной целесообразности более эффективной представляется более пластичная регуляция эндогенного суточного периода, обеспечивающая некоторый разброс вокруг 24-часового экзогенного периода, — своеобразная биоритмическая прецессия.
Таким образом, существует значительный объем данных, не позволяющих с полной уверенностью:
- Cчитать суточные изменения концентрации мелатонина у человека маркером системы циркадианной регуляции.
- Судить о влиянии искусственного освещения на систему циркадианной регуляции по показателям ритма концентрации мелатонина у человека.
- Ашофф Ю., Вивер Р. Циркадианная система человека. Биологические ритмы. Т. 1. М.: Мир, 1984.
- Батурин В. А., Арушанян Э. Б. Особенности перестройки циркадианной динамики двигательной активности крыс в ответ на фазовое смещение светового режима при экспериментальном моделировании депрессии // Журнал высшей нервной деятельности. 1994. Т. 44. Вып. 3.
- Бизяк Г., Кланичек-Гунде М., Кобав М. Б., Маловр-Ребек К. Спектры излучения и фотобиологическое действие светодиодов // Светотехника. 2013. №
- Брейнард Дж., Бернекер К. А. Влияние света на физиологию и поведение человека // Светотехника. 1996. № 1, 2.
- Кривоносов М. В., Мусульбас А. А. Реакция парасимпатической нервной системы при УФ-облучении разной длины волны. IX Всесоюзное совещание по биологическим действиям УФ-излучения. 1968.
- Ри М., Фигуэро М., Баллоу Д. Циркадная фотобиология: новые горизонты практической и теоретической светотехники // Полупроводниковая светотехника. 2012. № 4
- Сарычев Г. С. Облучательные светотехнические установки. М.: Энергоатом, 1992.
- Åkerstedt T., Fröberg J. E., Friberg Y., Wetterberg L. Melatonin excretion, body temperature and subjective arousal during 64 hours of sleep deprivation // Psychoneuroendocrinology. 1979. Vol. 4 (3).
- Arendt J. Melatonin and human rhythms // Chronobiology Int. 2006. Vol. 23 (1&2).
- Benloucif S., Burgess H. J., Klerman E. B., Lewy A. J., Middleton B., Murphy P. J., Parry B. L., Revell V. L. Measuring melatonin in humans // J. Clin. Sleep Med. 2008. Vol. 4 (1).
- Bicego K. C., Barros R. C., Branco L. G. Physiology of temperature regulation: comparative aspects // Comp. Biochem. Physiol. A Mol Integr. Physiol. 2007. Vol. 147 (3).
- Boyce P., Kennaway D. J. Effects of light on melatonin production // Biol/ Psychiatry. 1987. Vol. 22 (4).
- Bubenik G. A. Thirty four years since the discovery of gastrointestinal melatonin // J Physiol Pharmacol. 2008. Vol. 59.
- Buhr E. D., Yoo S.-H., Takahashi J. S. Temperature as a universal resetting cue for mammalian circadian oscillators // Science. 2010. Vol. 330 (6002).
- Burch J. B., Reif J. S., Yost M. G. Geomagnetic activity and human melatonin metabolite excretion // Neuroscience Letters. 2008. Vol. 438 (1).
- Campbell S. S., Broughton R. J. Rapid decline in body temperature before sleep: Fluffing the physiological pillow? // Chronobiol Int. 1994. Vol. 11(2).
- Chang A. M., Scheer F. A., Czeisler C. A., Aeschbach D. Direct effects of light on alertness, vigilance, and the waking electroencephalogram in humans depend on prior light history // Sleep. 2013. Vol. 36.
- Colquhoun W. P., Paine M. W., Fort A. Circadian rhythm of body temperature during prolonged undersea voyages // Aviat Space Environ Mad. 1978. Vol. 49 (5).
- Dai Q., Cai W., Hao L., Shi W., Wang Z. Spectral optimisation and a novel lighting-design space based on circadian stimulus // Lighting Res. Technol. 2017. V. 0.
- Dollins A. B., Zhdanova I. V., Wurtman R. J., Lynch H. J., Deng M. H. Effect of inducing nocturnal serum melatonin concentrations in daytime on sleep, mood, body temperature, and performance // Proc. Natd. Acad. Sci. USA. 1994. Vol. 91.
- Figueiro M., Nagare R., Price L. Non-visual effects of light: How to use light to promote circadian entrainment and elicit alertness // Lighting Research & Technology. 2017. Vol. 50 (1).
- Flouris A.D. Functional architecture of behavioural thermoregulation // Eur J Appl Physiol. 2011. Vol. 111 (1).
- Foret J., Daurat A., Touitou Y., Aguirre A., Benoit O. The effect on body temperature and melatonin of a 39-h constant routine with two different light levels at nighttime // Chronobiol Int. 1996. Vol. 13 (1).
- Giam G. C. Effects of sleep deprivation with reference to military operations // Ann Acad Med Singapore. 1997. Vol. 26 (1).
- Griefahn B., Brode P., Blaszkewicz M., Remer T. Melatonin production during childhood and adolescence: a longitudinal study on the excretion of urinary 6-hydroxymelatonin sulfate // J Pineal Res. 2003. Vol. 34.
- Gronfier C., Wright K. P., Kronauer R. E., Czeisler C. A. Entrainment of the human circadian pacemaker to longer-than-24-h days // PNAS. 2007. Vol. 104 (21).
- Hastings M. H., Herbert J., Martensz N. D., Roberts A. C. Annual reproductive rhythms in mammals: mechanisms of light synchronization // Ann N Y Acad Sci. 1985. Vol. 453.
- Hébert M., Dumont M., Paquet J. Seasonal and diurnal patterns of human illumination under natural conditions // Chronobiol Int. 1998. Vol. 15 (1).
- Henshaw D. L., Ward J. P., Matthews J. C. Can disturbances in the atmospheric electric field created by powerline corona ions disrupt melatonin production in the pineal gland? // J Pineal Res. 2008. Vol. 45 (4).
- Higuchi S., Motohashi Y., Ishibashi K., Maeda T. Influence of eye colors of Caucasians and Asians on suppression of melatonin secretion by light // Am J Physiol Regul Integr Comp Physiol. 2007. Vol. 292.
- Hunt P., Kelly T. Light levels aboard a submarine: Results of a survey with a discussion of the implications for circadian rhythms. San Diego, CA, Naval Health Research Center, 1995.
- Iguichi H., Kato K. I., Ibayashi H. Age-dependent reduction in serum melatonin concentrations in healthy human subjects // J Clin Endocrinol Metab. 1982. Vol. 55.
- Illnerova H., Backström M., Sääf J., Wetterberg L., Vangbo B. Melatonin in rat pineal gland and serum; rapid parallel decline after light exposure at night // Neuroscience Letters. 1978. Vol. 9 (2–3).
- Illnerova H., Zvolsky P., Vaneček J. The circadian rhythm in plasma melatonin concentration of the urbanized man: the effect of summer and winter time // Brain Res. 1985. Vol. 328.
- Jasser S. A., Hanfin J. P., Rollag M. D., Brainard G. C. Dim light adaptation attenuates acute melatonin suppression in humans // J Biol Rhythms. 2006. Vol. 21(5).
- Jimerson D. C., Lynch H. J., Post R. M., Wurtman R. J., Bunney W. E. Urinary melatonin rhythms during sleep deprivation in depressed patients and normals // Life Sciences. 1977. Vol. 20.
- Kauppila A., Kivela A., Pakarinen A., Vakkuri O. Inverse seasonal relationship between melatonin and ovarian activity in humans in a region with a strong seasonal contrast in luminosity // J Clin Endocrinol Metab. 1987. Vol. 65 (5).
- Kelly T. L., Neri D. F., Grill J. T., Ryman D., Hunt P. D., Dijk D.-J., Shanahan T. L., Czeisler C. A. Nonentrained circadian rhythms of melatonin in submariners scheduled to an 18-hour day // J Biol Rhythms. 1999. Vol. 14 (3).
- Kivela A., Kauppila A., Ylostalo P., Vakkuri O., Leppaluoto J. Seasonal, menstrual and circadian secretions of melatonin, gonadotropins and prolactin in women // Acta Physiol Scand. 1988. Vol. 132.
- Kleitman N. The sleep-wakefulness cycle of submarine personnel // Human factors in submarine warfare. Baltimore, Waverly Press, 1949.
- Kripke D. F., Elliott J. A., Youngstedt S. D., Smith J. S. Melatonin: marvel or marker? // Annals of Med. 1998. Vol. 30 (1).
- Kubota T., Uchiyama M., Suzuki H., Shibui K., Kim K., Tan X., Tagaya H., Okawa M., Inoue S. Effects of nocturnal bright light on saliva melatonin, core body temperature and sleep propensity rhythms in human subjects // Neuroscience Res. 2002. Vol. 42.
- Lazar A. S., Santhi N., Hasan S., Lo J. C.-Y., Johnston J. D., von Schantz M., Archer S. N., Dijk D.-J. Circadian period and the timing of melatonin onset in men and women: predictors of sleep during the weekend and in the laboratory // J Sleep Res. 2013. Vol 22.
- Lewy A. J., Cutler N. L., Sack R. L. The endogenous melatonin profile as a marker for circadian phase position // J Bioll Rhythms. 1999. Vol. 14(3).
- Lewy A. J., Sack R. L. The Dim Light Melatonin Onset as a marker for orcadian phase position // Chronobiology Int. 1989. Vol. 6 (1).
- Libert J. P., Candas V., Muzet A., Ehrhart J. Thermoregulatory adjustments to thermal transients during slow wave sleep and REM sleep in man // J Physiol (Paris). 1982, Vol. 78 (3).
- Martikainen H., Tapanainen J., Vakkuri О., Leppaluoto J., Huhtaniemi I. Circannual concentrations of melatonin, gonadotrophins, prolactin and gonadal steroids in males in a geographical area with a large annual variation in daylight // Acta Endocrinol (Copenh). European Journal of Endocrinology. 1985. Vol. 109.
- McIntyre I. M., Norman T. R., Burrows G. D., Armstrong S. M. Human melatonin suppression by light is intensity dependent // J Pineal Res. 1989. Vol. 6.
- Minors D. et al. Sleep and circadian rhythms of temperature and urinary excretion on a 22.8 hr «day» // Chronobiolog Int. 1988. Vol. 5(1).
- Mistlberger R. E., Skene D. J. Social influences on mammalian circadian rhythms: animal and human studies // Biol Rev Camb Philos Soc. 2004. Vol. 79 (3).
- Nathan P. J., Burrows G. D., Norman T. R. Melatonin sensitivity to dim white light in different seasons // Hum. Psychopharmacol. Clin. Exp. 1999. Vol. 14.
- Nathan P. J., Wyndham E. L., Burrows G. D., Norman T. R. The effect of gender on the melatonin suppression by light: a dose response relationship // J Neural Transm. 2000. Vol. 107.
- Panda S. Multiple photopigments entrain the Mammalian circadian oscillator // Neuron. 2007. Vol. 53 (5).
- Pandi-Perumal S. R., Smits M., Spence W., Srinivasan V., Cardinali D. P., Lowe A. D., Kayumov L. Dim light melatonin onset (DLMO): A tool for the analysis of circadian phase in human sleep and chronobiological disorders // Progress in Neuro-Psychopharmacology & Biological Psychiatry. 2007. Vol. 31.
- Paul M. A., Miller J. C., Love R. J., Lieberman H., Blazeski S., Arendt J. Timing light treatment for Eastward and Westward travel preparation // Chronobiol Int. 2009. Vol. 26 (5).
- Rensing L., Ruoff P. Temperature effect on entrainment, phase shifting, and amplitude of circadian clocks and its molecular bases // Chronobiol Int. 2002. Vol. 19 (5).
- Ritz-de Cecco A. Melatonin profile as a marker of circadian phase and amplitude in humans living on non-24 h days. Doctoral and Habilitation Theses. 2004.
- Salinas E. O., Hakim-Kreis C. M., Piketty M. L., Dardennes R. M., Musa C. Z. Hypersecretion of melatonin following diurnal exposure to bright light in seasonal affective disorder: preliminary results // Biol Psychiatry. 1992. Vol. 32.
- Silman R. E. Melatonin: a contraceptive for the nineties // Europ J Obstetr Gynecol and Reproduct Biol. 1993. Vol. 49.
- Smith K. A., Schoen M. W., Czeisler C. A. Adaptation of human pineal melatonin suppression by recent photic history // J Clin endocrinol Metab. 2004. Vol. 89.
- Thompson C., Stinson D., Smith A. Seasonal affective disorder and season-dependent abnormalities of melatonin suppression by light // Lancet. 1990. Vol. 336.
- Tosini G., Ferguson I., Tsubota K. Effects of blue light on the circadian system and eye physiology // Molecular Vision. 2016. Vol. 22.
- Trinder J., Armstrong S. M., O’Brien C., Luke D., Martin M. J. Inhibition of melatonin secretion onset by low levels of illumination // J Sleep Res. 1996. Vol. 5.
- Ueno-Towatari T., Norimatsu K., Blazejczyk K., Tokura H., Morita T. Seasonal variations of melatonin secretion in young females under natural and artificial light conditions in Fukuoka, Japan // J Physiol Anthropol. 2007. Vol. 26 (2).
- Van den Heuvel C. J., Noone J. T., Lushington K., Dawson D. Changes in sleepiness and body temperature precede nocturnal sleep onset: Evidence from a polysomnographic study in young men // J Sleep Res. 1998. Vol. 7.
- Vakkuri O., Leppäluoto J., Vuolteenaho O. Development and validation of a melatonin radioimmunoassay using radioiodinated melatonin as tracer // Acta Endocrinol (Copenh). 1984. Vol. 106 2).
- Vaughan G. M., Allen J. P., Tullis W., Siler-Khodr T. M., de la Pena A., Sackman J. W. Overnight plasma profiles of melatonin and certain adenohypophyseal hormones in men // J Clin Endocrinol Metab. 1978. Vol. 47 (3).
- Waldhauser F., Weiszenbacher G., Tatzer E., Gisinger B., Waldhauser M., Schemper M., Frisch H. Alterations in nocturnal serum melatonin levels in humans with growth and aging // J Clin Endocrinol & Metabolism. 1988. Vol. 66 (3).
- Werken van de M., Gimenez M. C., de Vries B., Beersma D. G. M., Gordijn M. C. M. Short-wavelength attenuated polychromatic white light during work at night: limited melatonin suppression without substantial decline of alertness // Chronobiology Int. 2013. Vol. 30 (7).
- Yasukouchi A., Ishibashi K. Non-visual effects of the color temperature of fluorescent lamps on physiological aspects in humans // J Physiol Anthropol Appl Human Sci. 2005. Vol. 24 (1).
- Dijk D.-J. et al. Amplitude Reduction and Phase Shifts of Melatonin, Cortisol and Other Circadian Rhythms after a Gradual Advance of Sleep and Light Exposure in Humans // PLoS ONE. 2012. 7 (2).

 22 января, 2021
22 января, 2021 18 декабря, 2021
18 декабря, 2021 10 сентября, 2021
10 сентября, 2021